|
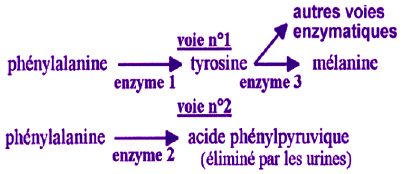
Deux voies de
dégradation métabolique de la phénylalanine sont connues :
-
¹ la
voie n°1 chez les sujets sains : l'enzyme 1 (= phénylalanine
hydroxylase ou PAH) est décelable dans les cellules hépatiques (= du
foie) de l'individu sain) ; chez les sujets atteints de la maladie, l'enzyme
1 n'est pas fonctionnelle (suite à une mutation du gène qui code
pour elle),
-
¹ la
voie n°2 chez les sujets malades. Elle n'est utilisée qu'en cas
d'augmentation anormale du taux de phénylalanine dans le sang.
L'acide phénylpyruvique, molécule toxique qui détruit les neurones (=
cellules nerveuses) et est à l’origine du retard mental des sujets
sans traitement. Chez les sujets non atteints, cette voie n'est jamais
activée car les taux de phénylalanine restent faibles (la voie n°1
utilisant la phénylalanine comme substrat, cette molécule n'est jamais
en grande quantité dans l'organisme).
Remarque
: la chaîne de biosynthèse de la mélanine à partir de la tyrosine
est beaucoup plus complexe que ce qui est indiqué dans le document :
plusieurs réactions catalysées par plusieurs enzymes interviennent.
La phénylcétonurie
peut s’éviter grâce à un régime alimentaire approprié, appauvri
en phénylalanine (voir graphique ci-contre). A la naissance, on détecte
la pathologie chez un nourrisson par les taux très élevés de
phénylalanine (apports de cet acide aminé par le lait naturel) ; à
l'hôpital, on remplace le lait maternel par un lait de régime (= lait
carencé en phénylalanine). La courbe montre l'évolution de la
concentration plasmatique de phénylalanine chez le nourrisson. |
![]()